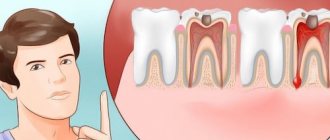
Лидокаин это эффективное обезболивающее средство. Местные анестезирующие средства угнетают ионные потоки, участвующие в образовании раздражителя, за счет чего и достигается обезболивающий эффект. Лидокаин стабилизирует нейронные мембраны, подавляет нервную проводимость, сокращает степень деполяризации.
Когда показан Лидокаин?
В спектр показаний раствора Лидокаина входят следующие условия:
- Местное обезболивание, требуемое для проведения манипуляций в офтальмологии, ЛОР-практике, стоматологии, при хирургическом вмешательстве.
- Применение в качестве растворителя антибактериальных препаратов группы цефалоспоринов, введение которых характеризуется выраженным болевым эффектом.
Лидокаин для инъекций позволяет на несколько часов обезболить необходимый участок кожи или слизистой, чего будет достаточно для проведения врачебной манипуляции, сопровождаемой повышенной чувствительностью.
Как применяется раствор Лидокаина?
Раствор местного анестетика предварительно тестируется на отдельном участке кожи, что позволяет оценить наличие или отсутствие индивидуальной негативной реакции на препарат.
Дозировка раствора Лидокаина зависит от типа анестезии:
- Терминальный тип анестезии подразумевает местное нанесение раствора (2мг на кг веса), максимум 20 мл для взрослого пациента. Длительность эффекта составляет не более 30 минут.
- Проводниковый тип анестезии. Дозировка зависит от масштабности участка, который необходимо обезболить. Максимальная доза 20 мл.
- В офтальмологии раствор закапывается в конъюнктивальный мешок.
- Эпидуральная анестезия – 22-30 мл раствора.
- Обезболивание в акушерстве и гинекологии – 20-30 мл раствора.
- В детском возрасте дозировка определяется в индивидуальном порядке (в среднем 3,5-4мг на кг веса).
Для предотвращения развития побочных эффектов раствор необходимо вводить строго в рекомендованных дозировках. Медикамент Лидокаин, инструкция по применению к которому содержит все необходимые дозировки, необходимо назначать после детального изучения анамнеза.
Современные аналоги новокаина в стоматологии –
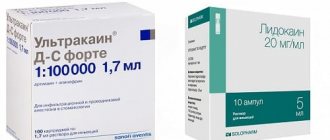
Лидокаин пришел на смену новокаину примерно в 90-х годах. Лидокаин в 2,5 раза сильнее новокаина по глубине анестезии и продолжительности эффекта, а также он не теряет эффективности при введении в зоне очага воспаления (например, при гнойных абсцессах). Намного ниже у лидокаина и частота побочных эффектов. Но как мы сказали выше – в стоматологии лидокаин используется сейчас только в провинциальных медучреждениях, т.к. по глубине и продолжительности анестезии – лидокаин уступает в 2-3 раза препаратам артикаина (например, ультракаину).
Лидокаин 2% раствор в ампулах по 2 мл –
И хотя в стоматологии лидокаин сейчас практически не применяется – в общей хирургии он по-прежнему является одним из наиболее широко используемых местных анестетиков (24stoma.ru). Наиболее популярными анестетиками в стоматологии сейчас являются препараты на основе артикаина (например, ультракаин, убистезин, септанест и другие). Для стоматологов эти препараты выпускаются уже не в стеклянных или пластиковых ампулах, а в специальных стеклянных карпулах.
Карпульный шприц и карпулы анестетика –
Каждая карпула содержит 1,7 мл анестетика и уже готова для применения (т.е. ее не нужно вскрывать). Она целиком вставляется в специальный карпульный шприц, в который со стороны носика шприца затем ввинчивается специальная двухсторонняя игла. При нажатии на поршень шприца – последний давит на подвижную резиновую вкладку, расположенную в нижней части карпулы, что вызывает увеличение давления внутри карпулы и приводит к выходу раствора анестетика через иглу в ткани.
Как проводится анестезия в стоматологии –
Подробнее о современной анестезии в стоматологии – читайте в статье: → Обезболивание в стоматологии
Побочные реакции
При неправильном применении возможно возникновение побочных реакций:
- Головокружение, сонливость, судороги, нарушение чувствительности.
- Звон в ушах.
- Изменения АД, нарушение сердечной деятельности.
- Тошнота, рвота.
- Ощущение жара, отечность в месте укола.
- Чувство жжения, тромбофлебит.
Перечень побочных реакций значительно шире, поэтому необходимо осуществлять контроль за состоянием пациента после введения раствора Лидокаина.
Противопоказания при применении Лидокаина и Новокаина
Противопоказания к использованию Лидокаина:
- тяжелые нарушения функции печени;
- AV-блокада II и III степени;
- СССУ у пожилых пациентов;
- тяжелые формы хронической сердечной недостаточности;
- кардиогенный шок;
- выраженная брадикардия;
- инфицирование места предполагаемой инъекции;
- артериальная гипотензия;
- шок;
- тяжелые кровотечения.
Новокаин запрещен при чрезмерной чувствительности к составляющим препарата.
Противопоказания к применению раствора Лидокаин
Применение лекарственного препарата запрещено у пациентов с индивидуальной непереносимостью действующего вещества. Также Лидокаин уколы запрещены для применения при следующих состояниях:
- Первые несколько месяцев после инфаркта миокарда.
- Тяжелые сердечные патологии с брадикардией.
- Инфекционный процесс в месте инъекции.
- Период беременности, лактации.
- Детский возраст (до 15 лет).
- Судороги на фоне эпилепсии.
При указанных состояниях применять раствор Лидокаина не рекомендуется.
Современные подходы к ведению больных с болью в спине
П.Р.Камчатнов
Российский государственный медицинский университет, Москва
Одним из наиболее распространенных клинических синдромов является боль в пояснично-крестцовой области (боль в спине), обусловленная вертеброгенной патологией. Боль в спине встречается у 60–80% взрослой популяции и является одной из наиболее частых причин временной утраты трудоспособности. Эпизоды болей в спине ежегодно развиваются у половины трудоспособного населения, при этом наиболее часто поражаются лица в возрасте 35–55 лет. Число таких пациентов исключительно высоко, особенно в условиях амбулаторного неврологического приема. Считается, что в подавляющем большинстве случаев (около 90%) длительность болевого синдрома не превышает 6 нед, вместе с тем у остальных пациентов боль приобретает хронический характер. Регистрируется тенденция к росту частоты заболеваний опорно-двигательного аппарата. Так, в Российской Федерации число таких больных за последние 10 лет (1988–1997 гг.) выросло с 7,7 до 11,2 млн (более чем на 40%). Следует учитывать, что реальная распространенность этих заболеваний, вероятно, значительно выше.
Основными причинами боли в спине являются дегенеративные изменения позвоночника, в частности остеохондроз, дисфункция фасеточных суставов, частичный надрыв фиброзного кольца, пролабирование межпозвонковых дисков, в ряде случаев осложненный формированием грыжи диска, спондилолистез, стеноз спинального канала, остеопороз. Необходимо учитывать, что у ряда пациентов источником болевых ощущений могут являться воспалительные изменения позвонков или прилегающих тканей (спондилит, остеомиелит, эпидуральный абсцесс), в том числе обусловленные воздействием специфического возбудителя (например, палочки Коха). Причиной болевого синдрома может явиться первичная или метастатическая опухоль позвонков, мозговых оболочек или спинальных корешков. Наконец, боль в спине может быть не связана с патологией позвоночника, а носить отраженный характер при широком спектре соматических заболеваний, поражающих органы малого таза, тазобедренный сустав, нисходящий отдел аорты и пр. Разнообразие причин болевого синдрома требует исключительной тщательности при постановке диагноза и выработке лечебной тактики. Помимо детального анализа клинической картины заболевания и проведения радиологического исследования (включая использование компьютерной томографии – КТ и магнитно-резонансной томографии – МРТ) нередко возникает необходимость в углубленном соматическом обследовании больного.
Значимыми факторами риска развития поражения межпозвонковых дисков являются малоподвижный образ жизни с отсутствием физических нагрузок или, наоборот, повышенные физические нагрузки с повторной микротравматизацией позвоночника, воздействие вибрации, избыточная масса тела, высокий рост, повторные беременности. Большую роль играют производственные факторы – длительное пребывание в автотранспорте, частые переохлаждения, несоответствие между физическими возможностями индивидуума и объемом испытываемых нагрузок. Врожденные особенности строения скелета (асимметрия длины ног, аномалии строения тазобедренных суставов, люмбализация или сакрализация и пр.) также могут рассматриваться в качестве факторов, предрасполагающих к возникновению дегенеративных поражений позвоночника. Имеются сведения о генетической детерминированности поражения межпозвонковых дисков, в частности, обусловленной нарушением выработки коллагена 1Х типа.
Наличие длительно существующего хронического болевого синдрома в области спины или поясницы тесно ассоциировано с развитием депрессии, тревожных нарушений, при этом частота депрессивных расстройств среди больных со спондилогенными дорсопатиями в 3–4 раза выше, чем в популяции в целом. Имеется зависимость выраженности и длительности болевого синдрома и тяжести последующих нарушений двигательного стереотипа и эмоциональных расстройств. Наличие депрессивных и тревожных расстройств, в особенности в сочетании с болевым синдромом, способно не только вызывать снижение качества жизни пациентов, но и приводить к стойкой утрате трудоспособности. Даже при купировании острых болей эмоциональные расстройства могут персистировать на протяжении достаточно длительного времени, обусловливая дезадаптацию пациента.
Ведение больного в остром периоде
Основными задачами ведения больного в остром периоде болевого синдрома в рамках спондилогенной дорсопатии являются купирование болевого синдрома, восстановление нормальной биомеханики позвоночника, создание условий для проведения полноценного курса реабилитационных мероприятий. Максимально раннее и полное купирование болевого синдрома способно предупредить фиксацию патологического двигательного стереотипа, обеспечить возможность раннего проведения реабилитационных мероприятий. Кроме того, своевременное устранение болевых ощущений обеспечивает, с одной стороны, возможность для раннего подключения двигательной терапии и его активизации, а с другой – предупреждает становление эмоциональных расстройств. В настоящее время целесообразность выбора терапевтической тактики, препятствующей хронизации патологического процесса, не вызывает сомнений.
С целью устранения патогенных физических факторов, способных вызвать усиление болевого синдрома, показано обеспечение щадящего двигательного режима, полное исключение или ограничение физических нагрузок («лучше три дня лежать, чем неделю лечиться»). Желательно обеспечение щадящего режима в домашних условиях или неврологическом стационаре. Пациент должен избегать флексорных или ротационных движений в поясничном отделе позвоночника, в особенности выполняемых в быстром темпе или с дополнительными физическими нагрузками. При невозможности госпитализации следует обеспечить иммобилизацию соответствующего отдела позвоночника при помощи ортезов, фиксирующих поясов (корсетов), снабженных вертикальными ребрами жесткости. В острой стадии заболевания, характеризующейся наличием выраженного болевого синдрома, как правило, нецелесообразно проведение активных гимнастических упражнений, ручного массажа, а также применение тепловых процедур, сеансов мануальной терапии. В то же время при относительно нетяжелых обострениях, в случае умеренно выраженного болевого синдрома, при преобладании мышечно-тонических расстройств, можно достичь положительного эффекта проведением постизометрической релаксации.
НПВП и анальгетики
На сегодняшний день не вызывает сомнения целесообразность применения нестероидных противовоспалительных препаратов (НПВП) для лечения пациентов с спондилогенной дорсопатией. Эффективность такого подхода установлена в ходе целого ряда клинических исследований. Характерной особенностью фармакологического действия этих препаратов является способность угнетать активность циклооксигеназы-2 (ЦОГ-2) – ключевого фермента синтеза простагландинов, простациклинов и тромбоксанов. Известна роль ЦОГ-2 в качестве важнейшего катализатора в процессе метаболизма арахидоновой кислоты, который сопровождается образованием медиаторов отека и воспаления. Оказывая влияние на болевые окончания в очаге повреждения, простагландины повышают их чувствительность к брадикинину – пептиду, образующемуся в тканях при воспалении и одновременно являющемуся стимулятором болевых окончаний.
Вместе с тем торможение активности ЦОГ-2 при болевых синдромах, связанных с различной степени выраженности воспалительным процессом, не является единственным анальгетическим механизмом НПВП. Различная выраженность способности подавлять синтез простагландинов, наблюдающаяся у препаратов этой группы, диссоциация между противовоспалительным и анальгетическим эффектами НПВП позволяют предполагать существование иных механизмов реализации обезболивающих эффектов при спондилогенных дорсопатиях. Кроме того, не выявлено прямой зависимости между степенью подавления синтеза медиаторов воспаления, с одной стороны, и анальгетической активностью препаратов – с другой.
Несомненными преимуществами фармакокинетики лекарственных средств данной группы являются короткий период полувыведения, отсутствие аккумуляции и энтеропеченочной рециркуляции, длительное накопление в области воспаления. Благодаря этим качествам лекарства имеют хорошее соотношение польза/риск. Быстрота наступления обезболивающего действия служит основанием для назначения этих средств в первую очередь для купирования острых болевых синдромов различной интенсивности. Наиболее распространенными препаратами этой группы являются диклофенак, кеторолак, производные оксикамов (пироксикам, лорноксикам), производные пропионовой кислоты (ибупрофен, флурбипрофен, кетопрофен, напроксен).
Широко применяемый диклофенак характеризуется хорошей переносимостью, сочетающейся с выраженным обезболивающим эффектом. В клинической практике удобно использование пролонгированной формы диклофенак-ретард, содержащей 100 мг активного вещества. Прием пищи не оказывает клинически значимого влияния на всасывание активного вещества из таблеток ретард и его системную биодоступность. Степень абсорбции находится в прямой зависимости от дозы препарата. Среднее значение максимальной концентрации препарата в плазме достигается в среднем через 4 ч и сохраняется в течение 24 ч.
Производные пропионовой кислоты имеют малый период полувыведения, составляющий порядка 4 ч, и характеризуются хорошей переносимостью при относительно низком риске побочных эффектов. Эти препараты быстро всасываются в кишечнике и быстро элиминируются, не кумулируются при нарушении метаболических процессов. Они обладают умеренной ингибирующей активностью на синтез простагландинов, поэтому по своему противовоспалительному действию уступают диклофенаку, индометацину и фенилбутазону. В связи с этим целесообразно их применение при относительно нетяжелых дорсопатиях с умеренным болевым синдромом.
К сожалению, подавляющее большинство НПВП обладает ульцерогенным действием, что заставляет в каждом индивидуальном случае решать вопрос о целесообразности их применения и способе введения в организм. Отсутствие заболеваний желудочно-кишечного тракта допускает возможность перорального приема. Считается, что риск возникновения гастропатии, обусловленной приемом НПВП, достоверно выше у лиц в возрасте старше 65 лет, при длительном (более 3 мес) приеме НПВП, в особенности при применении двух препаратов и более из этой группы, одновременном приеме кортикостероидов и непрямых антикоагулянтов и, соответственно, у больных язвенной болезнью желудка в анамнезе. Вероятными факторами риска являются женский пол, курение, злоупотребление алкоголем, наличие хеликобактерной инфекции. В качестве профилактических мероприятий, снижающих риск поражения слизистой оболочки желудка, могут быть использованы ингибиторы протонной помпы (омепразол по 20 мг 1 раз в сутки) или блокаторы Н2-гистаминовых рецепторов (ранитидин по 300 мг в сутки), а также антацидные препараты.
При плохой переносимости НПВП, наличии хронического гастрита, перенесенной язвенной болезни применение таблетированных лекарственных форм исключено. В этом случае возможно их парентеральное (внутримышечное) или ректальное (в виде свечей) введение. Использование ректальных суппозиториев характеризуется высокой скоростью всасывания (она может соответствовать таковой при пероральном приеме или быть незначительно ниже ее). Так, после ректального введения 50 мг диклофенака максимальная концентрация его в плазме достигается в среднем в пределах 1 ч. К сожалению, угроза обострения желудочно-кишечной патологии полностью не исключается и в этой ситуации.
В последнее время широкое распространение получили трансдермальные формы НПВП (мази, кремы, гели). Необходимо четко представлять, что биодоступность препаратов при локальном введении, как правило, на порядок ниже, чем при пероральном применении. Серьезным недостатком трансдермальных лекарственных форм является малая концентрация действующего вещества и ограниченность прохождения препарата непосредственно к патологическому очагу. Большинством исследователей признается целесообразность применения трансдермальных форм при умеренно выраженных болевых синдромах, тогда как при выраженном болевом синдроме их эффективность явно недостаточна. Выраженный обезболивающий эффект проводимого лечения может быть достигнут при многократном (не менее 4–6 раз в сутки) нанесении препарата.
Большое внимание привлекают селективные ингибиторы ЦОГ-2, обеспечивающие ингибирование синтеза медиаторов воспаления и не оказывающие влияния на продукцию простаноидов (целекоксиб, нимесулид). Несомненным достоинством этих препаратов является относительно низкий риск поражения слизистой оболочки желудка и двенадцатиперстной кишки. Вместе с тем их обезболивающий эффект в острой стадии спондилогенной дорсопатии не всегда достаточен, что требует продления курса терапии или повышения доз препаратов.
В соответствии с современными представлениями о формировании болевых синдромов важная роль в формировании и регуляции болевых ощущений отводится опиоидным и неопиоидным противоболевым системам. Исходя из этого, можно предположить, что одним из наиболее специфических и надежных вариантов управления болью является воздействие на центральные механизмы формирования боли. Для уменьшения выраженности болевого синдрома у пациентов с болью в спине крайне редко приходится использовать наркотические препараты. Вместе с тем в ряде случаев положительный результат достигается вследствие применения ненаркотических анальгетиков. Одним из них является ацетаминофен (парацетамол) – эффективный болеутоляющий препарат, обладающий сложным механизмом действия. Есть основания полагать, что аналгезия при его применении достигается за счет повышения порога болевой чувствительности, хотя нельзя исключить и центральное действие препарата. Необходимо иметь в виду, что в больших дозах ацетоминофен способен оказывать нефро- и гепатотоксическое действие причем риск увеличивается при приеме алкоголя и прочих экзогенных интоксикациях.
Сроки применения НПВП и анальгетиков определяются интенсивностью болевого синдрома, курс их приема прекращается по мере достижения эффекта. Следует отметить нецелесообразность «профилактического» применения НПВП у больных со спондилогенными дорсопатиями при отсутствии болевого синдрома – убедительных подтверждений превентивного эффекта не получено, тогда как риск осложнений возрастает значительно.
Повышение эффективности применения НПВП может быть достигнуто за счет комбинирования лекарственных препаратов, воздействующих на различные звенья патогенеза болевого синдрома. Наблюдающаяся при этом потенциация эффекта позволяет использовать относительно низкие дозы препаратов и минимизировать фармакологическую нагрузку на организм пациента. С этой целью у некоторых пациентов может быть использовано внутривенное капельное введение смеси из обезболивающих препаратов, седативных, мочегонных средств. Помимо взаимно потенцирующего действия адекватно подобранных компонентов «коктейля», нельзя исключить психотерапевтического действия указанного способа лечения.
Миорелаксанты
Хорошим терапевтическим эффектом обладает комбинация обезболивающих средств с миорелаксантами, уменьшающими выраженность мышечно-тонических проявлений. Указанный комплекс может быть эффективным как при компрессионных, так и при рефлекторных синдромах. В качестве препаратов, снижающих повышенный мышечный тонус, используются производные бензодиазепинов (диазепам, тетразепам), толперизон, тизанидин. Тизанидин помимо расслабляющего действия на поперечнополосатую мускулатуру обладает умеренным гастропротективным действием. Механизм подобного эффекта не вполне ясен, хотя имеются данные о том, что препарат, оказывая влияние через центральные альфа-адренергические пути, тормозит выработку желудочного секрета, предотвращает изменения гликопротеинов, обусловленные действием ацетилсалициловой кислоты или НПВП, и повреждение слизистой оболочки желудка. Учитывая то, что практически все миорелаксанты в той или иной степени обладают седативным эффектом, следует информировать пациента о возможных побочных эффектах – сонливости, снижении концентрации внимания, заторможенности. Нередко выраженность этих эффектов ограничивает применение данной группы препаратов в амбулаторных условиях.
Противоотечная терапия
В ряде случаев компрессионный синдром сопровождается локальным венозным полнокровием, отеком корешка и окружающих его тканей, что делает целесообразным включение в терапевтический комплекс диуретиков (салуретиков или осмотических) и, в отдельных тяжелых случаях, кортикостероидов. Из гормональных препаратов обычно используются преднизолон (40–60 мг в сутки) или дексаметазон (4–8 мг в сутки) на протяжении 3–5 дней с последующей быстрой отменой. Необходимо учитывать повышенный риск осложнений со стороны желудочно-кишечного тракта при одновременном применении кортикостероидов и НПВП. В ряде стран применяется эпидуральное введение кортикостероидов. Получены данные об эффективности данного способа лечения у пациентов с остро развившимся болевым синдромом. Менее обосновано эпидуральное введение препаратов при умеренно выраженных болях в пояснице и нижней части спины, а также при их хроническом или подостром характере заболевания.
Комбинированные препараты
Удачной комбинацией лекарственных средств, обладающих обезболивающим и противоотечным действием, положительным образом влияющих на обмен веществ в периферическом нерве и окружающих тканях, является препарат «Амбене». Выпускается в виде готового для употребления двухкамерного шприца для инъекций, первая камера которого содержит 2 мл раствора фенилбутазона (375 мг) и 3,5 мг дексаметазона, вторая – 1 мл цианокобаламина (2,5 мг). Кроме того, в состав амбене входит лидокаин, добавление которого обеспечивает уменьшение болевых ощущений непосредственно в месте введения. Растворы смешиваются непосредственно перед употреблением. Лечебное воздействие компонентов, входящих в состав амбене, потенцируются, за счет чего обеспечивается быстрый и стойкий обезболивающий эффект.
Фенилбутазон представляет собой НПВП пиразолонового ряда, который за счет ингибирования активности ЦОГ уменьшает продукцию простагландинов и оказывает обезболивающее и противовоспалительное действие. Выраженный анальгетический эффект сочетается с хорошей переносимостью, благодаря чему суточная доза может составлять до 1200–1600 мг. Дексаметазон является синтетическим глюкокортикоидом с мощным противовоспалительным, противоаллергическим, десенсибилизирующим, а также противоотечным действием. Основные клинические эффекты реализуются вследствие угнетения высвобождения медиаторов воспаления эозинофилами, мембраностабилизирующего действия, уменьшения количества тучных клеток. Цианокобаламин (витамин В12) участвует в метаболизме целого ряда биологически активных веществ, обладает высокой биологической активностью, в том числе в отношении метаболических процессов в периферической нервной системе.
Амбене оказывает выраженный обезболивающий эффект у больных со спондилогенной дорсопатией, при этом отличается хорошей переносимостью. Препарат вводится внутримышечно 1 раз в сутки не чаще 1 раза в 2–3 дня. Следует учитывать, что отдельные компоненты препарата способны вызывать нежелательные побочные эффекты. Как и прочие НПВП, фенилбутазон оказывает ульцерогенное действие, относительно редко наблюдаются кожные проявления (крапивница, сухая экзема). Дексаметазон характеризуется низкой частотой возникновения побочных эффектов, вместе с тем необходимо иметь в виду возможность снижения толерантности к глюкозе, повышение риска развития эрозивно-язвенных поражений желудка и двенадцатиперстной кишки. Исходя из этого, амбене не следует применять у больных с острыми заболеваниями желудка и двенадцатиперстной кишки, нарушением обмена углеводов (снижение толерантности к глюкозе), индивидуальной непереносимости его отдельных компонентов.
Купирование как компрессионных, так и рефлекторных болевых синдромов может быть достигнуто применением блокады болезненных мышечных групп или триггерных точек. Технически правильно выполненные, эти манипуляции обладают достаточной эффективностью и не вызывают значимых осложнений. Требуется аккуратность при выполнении паравертебральных блокад во избежание травматизации спинальных корешков. Используются комбинации раствора анестетика (новокаин, лидокаин) и небольшой дозы кортикостероида (суспензия гидрокортизона, бетаметазона дипропионат). Локальное введение препаратов, обладающих системным, а не местным действием (антиагреганты, вазоактивные препараты, миорелаксанты и пр.), а также не обладающих способностью к депонированию в ткани, нецелесообразно. К сожалению, эффект, оказываемый блокадами в отношении болевого синдрома, не носит стойкого характера, в связи с чем возникает необходимость повторных манипуляций.
В ряде случаев применение НПВП, даже в комбинации с миорелаксантами, не оказывает должного положительного эффекта. Хронизация болевого синдрома сопровождается эмоциональными расстройствами, в частности с преобладанием депрессивных реакций, что диктует необходимость расширения фармакотерапевтического арсенала. Исследования последних лет убедительно продемонстрировали, что хронизация боли у пациентов с поясничными болями обусловлена причинами скорее психологическими, чем биомеханическими (т.е. связанными непосредственно с патологией позвоночника и корешков). Следствием этого является увеличение сроков процесса выздоровления, резкое ограничение возможности двигательной реабилитации больных, нарушение взаимодействия в системе «врач–пациент». Причинами, затрудняющими процесс восстановления, являются убежденность пациента в наличии прогрессирующего органического поражения позвоночника, в необходимости полного ограничения физических нагрузок, нарушения социальных функций, связанных с заболеванием, ориентация на пассивное (лекарственное, физиотерапевтическое), но не активное лечение (дозированные физические нагрузки, специальные упражнения). Мощным лечебным инструментом в этой ситуации является проведение разъяснительной психотерапии, формирование у больного оптимистических взглядов на перспективы лечения, выработка стратегии поведения на будущее (оптимальный объем и характер трудовых и бытовых нагрузок, проведение профилактических мероприятий и пр.).
Антидепрессанты и антиконвульсанты
В этой ситуации к лечению могут быть подключены антидепрессанты, причем желательно использовать препараты, оказывающие седативный и миорелаксирующий эффект (например, амитриптилин). Противоболевым эффектом обладает карбамазепин – эффективный антиконвульсант из группы производных иминостильбена. Препарат инактивирует натриевые каналы, угнетает высвобождение возбуждающих нейротрансмиттеров в синаптическую щель, вызывая снижение синаптической передачи. Помимо основного противосудорожного и обезболивающего действия препарат обладает антипсихотическим и антиманиакальным эффектами. Высказывается предположение о том, что положительный эффект карбамазепина у пациентов со спондилогенными дорсопатиями может быть опосредован воздействием на центральные ноцицептивные механизмы, нормализацией мышечного тонуса. Дозирование препарата осуществляется индивидуально, в зависимости от переносимости, а также от характера двигательного режима. Побочные эффекты (в первую очередь сонливость, нарушение концентрации внимания) требуют аккуратности в подборе дозы препарата, в особенности в амбулаторных условиях. Вероятность указанных расстройств возрастает при одновременном назначении седативных средств, антидепрессантов, некоторых миорелаксантов. Убедительных данных о целесообразности применения прочих антиконвульсантов не получено, хотя исследования такого рода проводятся.
В комплекс терапевтических мероприятий должны быть включены и немедикаментозные методы лечения – физиотерапия (фоно- или электрофорез лекарственных препаратов, воздействие электрическими токами специально подобранной конфигурации, частоты и напряжения, низкоэнергетическое лазерное излучение). Обезболивающим эффектом обладает рефлексотерапия в различных модификациях (традиционная акупунктура, электро- и лазеропунктура). Следует отметить значительные трудности при сравнении результатов применения различных физиотерапевтических методов лечения, явную недостаточность исследований их эффективности, удовлетворяющих требованиям доказательной медицины.
Имеющиеся на сегодняшний день данные свидетельствуют о существовании значительного арсенала фармакотерапевтических и нелекарственных способов купирования болевого синдрома у больных спондилогенными дорсопатиями. Представляется желательным индивидуальный выбор терапевтической тактики с использованием комбинации различных препаратов, их дозировок и способов введения. Сочетанное применение различных способов лечения позволяет повысить эффективность лечения и уменьшить фармакологическую нагрузку на организм. По мере купирования болевого синдрома абсолютно необходимым является использование методов восстановительной терапии, лечебной гимнастики, направленной на формирование мышечного корсета, укрепление мускулатуры брюшной стенки и спины. Не менее важным является обучение больного навыкам повседневной двигательной активности – формирование двигательного стереотипа, предупреждающего возникновение болевых ощущений.
Источник: https://www.consilium-medicum.com/media/consilium/04_08/557.shtml :: Wednesday, 10-Nov-2004 21:25:33 MSK
Взаимодействие раствора с другими препаратами
Лидокаин одновременно не рекомендуется сочетать со следующими группами препаратов:
- Анальгетики наркотической группы – грозит угнетением дыхания.
- Антикоагулянты – повышается риск кровотечений.
- Сердечные гликозиды – уменьшается их эффективность.
- Новокаиновая группа – повышается миорелаксация.
- Эталон – негативный эффект на дыхательную функцию.
Раствор Лидокаина следует с особой осторожностью сочетать при заболеваниях сердца и нервной системы, сопровождающихся систематическим приемом препаратов.
Что лучше – Лидокаин или Новокаин
Чтобы выяснить, какой препарат лучше применить – Лидокаин или Новокаин, врач оценивает состояние пациента и ситуацию. Первый препарат обладает глубоким действием обезболивания. В сравнении с другими мощными анестетиками, например, Ультракаином, Лидокаин показывает средний эффект. Однако он оказывает более сильное воздействие при лечении зубов, чем Новокаин. Последний медикамент часто применяют в ситуациях, когда не требуется быстрое и длительное обезболивание.
Лидокаин назначают не только для анестезии.
Препарат повышает проницаемость клеток для калия, в результате чего блокируется проникновение натрия. Благодаря такому качеству лекарство используют во время оперативного вмешательства на сердце и при инфаркте миокарда.
Что сильнее
Если требуется сильное обезболивающее средство, применяют Лидокаин. Он начинает действовать быстро и отличается продолжительностью эффекта.
Особые указания
Инъекционное введение Лидокаина должно производиться только под контролем врача. Лечение должно производиться под ЭКГ-контролем.
Перед началом лечения рекомендуется исследовать уровень калия в крови, так как при сниженном его содержании эффективность препарата снижается.
Лекарственное средство оказывает воздействие на ЦНС, поэтому не рекомендуется в период его применения садиться за руль или заниматься деятельностью с возможной угрозой для жизни.
Тщательное наблюдение требуется за пациентами со склонностью к судорогам, так как даже незначительные дозы могут усиливать судорожный эффект.
Необходимо с осторожностью комбинировать Лидокаин с теми препаратами, которые усиливают его биодоступность, либо замедляют его выведение, что может быть особенно опасным при почечной недостаточности в терминальной стадии.
При внутримышечном введении раствора Лидокаин может наблюдаться повышенная активность креатинфосфокиназы, что препятствует постановке диагноза инфаркт миокарда.
Быстрое введение раствора Лидокаина может привести к резкому снижению артериального давления, с возможностью развития коллапса. В данном случае следует рассматривать и токсическое действие лекарственного средства с оказанием кардиотоксического действия.
В чем разница
Чтобы выяснить разницу между препаратами, требуется их сравнение. Лидокаин – это амидное соединение, Новокаин – эфирное. Эфиры проявляют нестабильность в растворах, а при попадании в организм быстро распадаются. Продукты гидролиза нередко провоцируют аллергические реакции. Амиды оказывают относительную стабильность и медленно расщепляются. При этом редко возникает аллергия.
Отличается Лидокаин от Новокаина сильным обезболивающим эффектом. Выпускается он в виде раствора для уколов, глазных капель, спрея, геля и трансдермального пластыря для местного применения. Новокаин обладает умеренным обезболивающим эффектом. Производят его в виде инъекций в ампулах, ректальных свечей и инфузионного раствора. Кроме того, действие этого препарата длится недолго.
Лидокаин характеризуется антиаритмическим свойством, эффективно обезболивает ткани, неплохо взаимодействует с другими анестетиками. Препарат редко вызывает побочные явления. Новокаин обладает сосудосуживающим действием, улучшает микроциркуляцию крови и снижает возбудимость миокарда. Он чаще приводит к развитию негативных реакций организма.
Дозировку обоих медикаментов устанавливает врач, т. к. при передозировке может развиться апноэ, судорожные припадки и даже кома.