Нередко приходится слышать от родителей, что лечить молочные зубы необязательно. Ведь они сами собой выпадут. Но это распространенное мнение является ошибочным. Молочные зубы, конечно же, выпадут в свое время, но их болезни могут принести много страданий детям, а также повредить здоровью будущих постоянных зубов — вплоть до нарушения прикуса. Давайте разберемся, надо ли лечить молочные зубы, в каких случаях и как это делать.
Лечить или удалять молочные зубы
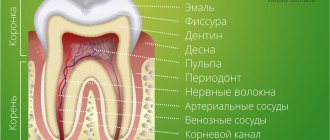
Прежде чем говорить о том, как лечат молочные зубы, необходимо отметить их особенности, отличающие их от постоянных. Прежде всего, молочные зубы имеют более тонкую эмаль, поэтому они очень уязвимы к кариесу и другим воздействиям. Кроме того, вопреки расхожему заблуждению, молочные зубы имеют также и корни, хотя они меньше и тоньше, чем корни постоянных зубов.
В связи с этим возникает вопрос: лечат ли молочные зубы у детей, или их можно удалить при возникновении проблем — ведь спустя некоторое время на их месте появятся постоянные. Здесь важно понимать, что между самопроизвольным выпадением молочного зуба и появлением постоянного чаще всего проходит очень небольшой промежуток времени. Фактически, молочный зуб выпадает в тот момент, когда уже готов развиваться постоянный. Но если удалить молочный зуб раньше положенного ему срока, на челюсти ребенка появится пустая лунка, которая многие недели и даже месяцы может оставаться без зуба. В этой ситуации соседние зубы начнут смещаться в сторону лунки, что увеличит промежутки между ними и создаст препятствия для роста постоянного зуба. Он может начать болеть, вырастет искривленным, формирование прикуса будет происходить неправильно — и ребенку, для того чтобы избежать серьезных проблем и вернуть красивую улыбку придется выдержать множество стоматологических процедур и даже, вероятно, носить брекеты. Поэтому современные стоматологи стараются всеми силами сохранить молочные зубы до их естественного выпадения — применяя разные методы вплоть до установки коронок.
Кроме того, задумываясь, зачем лечить молочные зубы, мы не должны забывать о главной функции зубов — жевательной. Если мы будем просто удалять больные молочные зубы у ребенка, то чем он будет жевать? В этом случае придется делать ребенку протез, поскольку до вылезания постоянных зубов на месте удаленных молочных может пройти много времени.
Почему важно сохранить временные зубы ребенка?
За каждый молочный зуб нужно решительно бороться, потому что от этого зависит:
- функция жевания: питание напрямую влияет на развитие организма, ребенок должен кушать с удовольствием и без всякого дискомфорта;
- формирование речи: от зубов зависит правильная артикуляция, следовательно, они необходимы для того, чтобы ребенок разговаривал четко и понятно;
- развитие зубочелюстной системы: преждевременная потеря молочных зубов приводит к серьезному смещению соседних зубов, из-за чего пропадает место для постоянного зуба и меняется прикус;
- психологический статус: осваивающийся в социуме малыш уязвим, что угодно может пошатнуть его самооценку, и он как никогда нуждается в широкой, белозубой улыбке.
Нужно ли лечить кариес молочных зубов
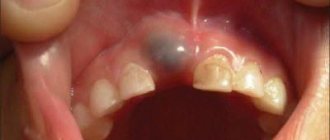
Из-за тонкой эмали молочные зубы очень подвержены кариесу. На самой ранней стадии кариес даже не требует сверления и пломбирования — можно обойтись полировкой зуба и нанесением специальной минерализующей пасты. Но если момент упущен и образовалась дырка, то лечение будет более серьезным. Но в любом случае родители, которые сомневаются, стоит ли лечить кариес молочных зубов, должны помнить, что на нежных молочных зубах с тонкой эмалью кариес развивается гораздо стремительнее, чем у взрослых. Поэтому сильная зубная боль может настигнуть ребенка внезапно в самой неподходящей ситуации — на даче у бабушки, в зарубежной поездке. Придется срочно искать подходящую клинику, возможно, тратить немалые деньги и рисковать здоровьем ребенка, потому что при некачественном удалении зуба в лунке могут остаться части корней, которые будут мешать прорезыванию постоянного зуба.
Кариес молочных зубов у детей лечат еще и потому, что он может стать источником инфекции, привести к периодонтиту, повредить находящиеся рядом уже постоянные зубы. Как и у взрослых, кариес у детей надо лечить обязательно, причем своевременно и как можно раньше, чтобы сохранить зуб и не повредить нормальному развитию челюсти и прикуса у ребенка.
Профилактика лучше лечения
Как и в случае со взрослыми, у детей проще сохранить здоровье зубов, чем устанавливать пломбы. Эта задача ложится на родителей.
Прежде всего, нужно чистить зубы с того момента, как они прорезываются. Для малышей есть мягкие силиконовые щетки, которые используют без пасты. Для детей от 2 лет – детские щетки и пасты. Есть также электрические звуковые щетки, которые вносят в рутинный процесс элемент игры: в специальном приложении ставят ежедневные «баллы», выдают «награду» за хорошую чистку зубов в течение 30 дней подряд и переводят на новый уровень. Нужно только выбрать щетку, подходящую для ребенка по возрасту, – чтобы щетина не была слишком жесткой.
Также не стоит забывать о плановых приемах. Если на первых приемах у врача ребенку не будут лечить зубы, а только осмотрят, он запомнит, что в посещении стоматолога нет ничего страшного. При необходимости лечения будет проще идти к знакомому доктору.
Можно ли еще как-то предотвратить развитие кариеса? Есть несколько профилактических процедур – реминерализация, фторирование эмали, герметизация фиссур (углублений жевательных зубов). В каком случае стоит проводить их, посоветует врач.
Когда настает время прорезывания постоянных зубов, корни молочных постепенно рассасываются – поэтому и удаляются легко и безболезненно. Лучше всего сделать так, чтобы первые зубки прослужили весь положенный срок, тогда риск проблем с постоянными зубами будет меньше.
Другие статьи:
- Когда нельзя исправлять прикус? Временные и постоянные противопоказания
- Что выбрать для ребенка – брекеты или элайнеры?
Нужно ли лечить пульпит на молочных зубах
Пульпит — это воспаление пульпы, т.е. нерва и окружающих его мягких тканей. Иногда почему-то считают, что у детей пульпит не возникает. Но в молочных зубах тоже присутствуют нервы и они точно так же могут воспалиться. Причинами являются:
- запущенный кариес,
- травма зуба,
- ошибка при лечении кариеса (дентин молочного зуба очень тонкий и стоматолог, не имеющий большого опыта в лечении именно молочных зубов у детей, может случайно вскрыть камеру пульпы),
- инфекционное заболевание (например, сильная ангина, в результате которой инфекция проникнет в зуб изнутри, через кровь).
Пульпит у детей встречается нечасто, но все же встречается. Поэтому лечить его надо обязательно. В противном случае он может стать хроническим и не только приведет к слишком ранней потере зуба, но и может передать воспаление новому зарождающемуся постоянному зубу.
Пульпит в молочных зубах сейчас лечат тремя способами:
- Классической девитальной ампутацией: больной нерв убивается специальной пастой, через несколько дней пульпа удаляется и зуб пломбируется. Сейчас такой метод считается устаревшим, но тем не менее иногда применяется.
- Витальной ампутацией: если воспалена только часть нерва, то в самом начале воспаления возможно под анестезией удаление именно пораженной части нерва, а на остальную накладывается антисептическое противовоспалительное средство и зуб пломбируется. Операция сложная и оставляет вероятность повторного воспаления пульпы.
- Витальной экстрипацией пульпы: под сильной анестезией воспаленная пульпа удаляется полностью и пульпарная камера пломбируется специальной цинкэвгеноловой пастой, которая в будущем будет рассасываться вместе с корнями молочного зуба. Метод эффективный, но дорогой и требующий высокой квалификации стоматолога.
Гораздо чаще врачи предлагают просто удалить молочный зуб, пораженный пульпитом. Это и проще и дешевле, но, к сожалению, здесь есть вероятность смещения соседних зубов (если постоянный зуб прорежется нескоро), что может привести к формированию неправильного прикуса. Чтобы избежать такой ситуации, лучше всего не доводить ситуацию до развития пульпита, а лечить кариес как можно раньше.
Лечение уреаплазменной инфекции урогенитального тракта
Уреаплазменную инфекцию лишь условно можно отнести к инфекциям, передаваемым половым путем. Дело в том, что возбудителем при этом является Ureaplasma urealyticum из семейства микоплазм, которые действительно могут обитать в половых путях и передаваться при половых контактах. Однако роль уреаплазм, как и других микоплазм, за исключением M. genitalium, в возникновении воспалительной реакции достаточно неоднозначна, вследствие чего этот возбудитель большинство авторов, особенно за рубежом, относят к условно-патогенным. И в МКБ-10, международно признанном списке болезней, такого заболевания, как уреаплазмоз или уреаплазменная инфекция, не приведено. Между тем ряд исследователей приводят достаточно убедительные доказательства, свидетельствующие в пользу патогенности этой инфекции. Не так давно в Москве даже была защищена докторская диссертация, автор которой отстаивал именно эту точку зрения.
В 1954 г. Шепард впервые обнаружил U. urealyticum в выделениях, полученных от больного уретритом, и назвал их Т-микоплазмами (от английского слова tiny — крошечный). По своим размерам уреаплазмы являются одними из самых мелких представителей бактериальной флоры, выявляемой у человека, а по виду своей жизнедеятельности относятся к внутриклеточным паразитам.
Известны два биовара уреаплазм — Parvo и Т960, которые разделены на 14 сероваров. Последние достижения молекулярной биологии в исследовании ДНК и рибосомальной РНК уреаплазм позволили некоторым авторам (F. Kong et al., 2000) отказаться от классической классификации и разделить все уреаплазмы на два вида — Ureaplasma urealyticum (бывший биовар Т960) и Ureaplasma parvum (бывший биовар Parvo).
Как уже говорилось выше, вопрос о роли уреаплазм в этиологии и патогенезе заболеваний урогенитального тракта до сих пор не решен. Слишком уж широко они распространены, и слишком часто эти микроорганизмы выявляются у лиц, не имеющих клинической симптоматики. Авторы, относящие уреаплазмы к облигатным патогенам, считают, что они вызывают уретриты, цервициты, простатиты, послеродовые эндометриты, пиелонефриты, бесплодие, различную патологию беременности (хориоамниониты) и плода (легочную патологию). Другие исследователи полагают, что уреаплазмы являются частью условно-патогенной флоры урогенитального тракта и способны вызывать инфекционно-воспалительные заболевания мочеполовых органов только при определенных условиях (в частности, при недостаточности иммунитета) или при соответствующих микробных ассоциациях.
Показатели инфицированности урогенитального тракта уреаплазмами среди сексуально активного населения варьируют от 10 до 80%. Уреаплазмы, как правило, обнаруживают у людей, ведущих активную половую жизнь, а наиболее часто эти микроорганизмы выявляются у лиц, имеющих три и более половых партнеров. По данным F. Kong et al., у 81-87% больных выявляется Ureaplasma parvum и у 13-19% — Ureaplasma urealyticum. Клиническая картина воспалительного процесса, при котором обнаруживаются уреаплазмы, не имеет патогномоничных симптомов.
Авторы некоторых работ утверждают, что именно уреаплазмы зачастую являются причиной неблагоприятных исходов беременности, усугубляют риск преждевременных родов и летального исхода при рождении детей с очень низкой массой тела.
Вопрос о влиянии уреаплазм на репродуктивную функцию человека остается открытым. Между тем женское бесплодие может быть связано с воспалительными процессами в области половых органов, индуцированными уреаплазмами, приводящими к нарушению прохождения яйцеклетки в полость матки. Мужское бесплодие может быть обусловлено, во-первых, воспалительными процессами, а во-вторых — влиянием уреаплазм на сперматогенез. Адсорбция уреаплазм на поверхности сперматозоидов способна изменять их подвижность, морфологию и хромосомный аппарат.
Как и для большинства представителей условно-патогенной флоры, для уреаплазм выделяют ряд факторов, способствующих развитию инфекционно-воспалительных процессов. Наиболее важными из них являются иммунные нарушения, изменения гормонального статуса, массивность колонизации, ассоциации с другими бактериями. Все эти аспекты следует учитывать при выборе тактики ведения таких больных.
Методы диагностики
- Культуральное исследование на селективных средах. Такое исследование позволяет в течение 3 дней выделить культуру возбудителя и отделить уреаплазмы от других микоплазм. Материалами для исследования служат соскобы из урогенитального тракта и моча пациента. Метод позволяет определить чувствительность выделенных возбудителей к различным антибиотикам, что очень важно с учетом нередкой сегодня антибиотикорезистентности. Специфичность метода составляет 100%. Этот метод используется для одновременного выявления Mycoplasma hominis и Ureaplasma urealyticum.
- Обнаружение ДНК возбудителей методом ПЦР. Исследование позволяет в течение суток выявить возбудителя в соскобе из урогенитального тракта и определить его видовую принадлежность.
- Серологические тесты. Позволяют определять присутствие антигенов и специфических антител к ним в крови. Могут быть полезны при рецидивирующем течении болезни, при развитии осложнений и бесплодии.
Как и проблема патогенности уреаплазм, вопрос о необходимости элиминации этих возбудителей из урогенитального тракта также остается открытым. Чаще всего авторы предлагают принимать меры по элиминации этих микроорганизмов при наличии у человека инфекционно-воспалительного процесса в месте их обнаружения (уретрите, простатите, цервиците, вагините), а также при бесплодии, невынашивании беременности, воспалительных заболеваниях органов малого таза, хориоамнионите, послеродовых лихорадочных состояниях при наличии уреаплазм в мочеполовом тракте.
Этиотропное лечение уреаплазменной инфекции основывается на применении антибактериальных препаратов различных групп. Активность препаратов в отношении любой инфекции определяется по минимальной подавляющей концентрации (МПК) в исследованиях in vitro. Показатели МПК, как правило, коррелируют с результатами клинического излечения. Казалось бы, оптимальными препаратами должны являться антибиотики с наименьшей МПК, но при этом нельзя сбрасывать со счетов важность таких параметров, как биодоступность, способность к созданию высоких внутритканевых и внутриклеточных концентраций, переносимость и комплаентность лечения.
Уреаплазмы устойчивы к β-лактамным антибиотикам (пенициллинам и цефалоспоринам), из-за того что у них отсутствует клеточная стенка, и сульфаниламидам, так как эти микроорганизмы не синтезируют кислоту. При лечении уреаплазменной инфекции могут быть эффективны те антибактериальные агенты, которые воздействуют на синтез белка и ДНК, т. е. обладающие бактериостатическим действием. Это препараты тетрациклинового ряда, макролиды, фторхинолоны, аминогликозиды, левомицетин и некоторые другие (см. табл. 1).
Как видно из таблицы, доксициклин и кларитромицин отличаются наилучшими показателями МПК, кроме того, они высокоактивны в отношении уреаплазм. Другие препараты обладают избирательной активностью и их выбор определяется в зависимости от результатов микробиологических исследований.
Тетрациклины
Из антибиотиков тетрациклинового ряда наиболее удобны в применении доксициклин и миноциклин, поскольку они, в отличие от других препаратов этой группы, могут применяться 1-2 раза в день. В настоящее время миноциклин в РФ не зарегистрирован.
Согласно методическим рекомендациям 1998 г. и Федеральному руководству по использованию лекарственных средств, при уреаплазменной инфекции рекомендуется назначение доксициклина (юнидокс солютаб, вибрамицин, медомицин). Препарат назначают по 100 мг 2 раза в день в течение 7-14 дней. Обычно при первом приеме антибиотика дозу удваивают. По рекомендациям Американского центра по контролю и профилактике заболеваний (CDC), доксициклин, наравне с эритромицином и офлоксацином, является препаратом выбора при лечении негонококковых уретритов (НГУ). Менее удобен для пациента курс тетрациклина, который применяют по 500 мг 4 раза в день в течение 7-10 дней.
Доксициклин используют в виде двух солей, в зависимости от того, применяют антибиотик в капсулах или в виде порошка. В капсулах используют доксициклина гидрохлорид или хиклат. Порошок для приготовления других пероральных форм представляет собой моногидрат доксициклина. Использование соли моногидрата вместо гидрохлорида исключает возникновение эзофагитов. Наиболее удобной в применении является лекарственная форма солютаб.
Благодаря своим особым фармакокинетическим свойствам, доксициклин переносится гораздо лучше, чем тетрациклин.
Хорошие результаты были получены при назначении доксициклина женщинам, инфицированным различными микоплазмами (в том числе уреаплазмами) и страдающим бесплодием или привычным невынашиванием беременности. После санации от микоплазм в ряде случаев наступала беременность, которая заканчивалась нормальными родами в срок и без осложнений.
Необходимо, однако, отметить, что от 2 до 33% штаммов уреаплазм могут быть устойчивы к тетрациклину. К другим существенным недостаткам препаратов тетрациклинового ряда можно отнести противопоказания к их назначению беременным и детям до 8 лет, высокую частоту побочных реакций со стороны желудочно-кишечного тракта, а также фотосенсибилизацию кожи во время их применения.
Макролиды, линкозамины, стрептограмины
Из препаратов группы макролидов, азалидов, линкозаминов и стрептограминов наиболее предпочтительны кларитромицин, джозамицин, азитромицин, мидекамицин и эритромицин.
Как уже упоминалось выше, наилучшие показатели МПК из всех макролидных антибиотиков имеет кларитромицин, обладающий всеми преимуществами современных антибиотиков, относящихся к этому классу: хорошей переносимостью, небольшой частотой побочных реакций и высоким комплайенсом.
Кларитромицин (клабакс, клацид) назначают по 250 мг 2 раза в сутки, а в пролонгированной форме СР по 500 мг 1 раз в сутки, в течение 7-14 дней.
Джозамицин (вильпрафен) по 500 мг 3 раза в сутки в течение 7-14 дней.
Азитромицин (азитрал, сумамед, хемомицин) назначают по 250 мг 1 раз в сутки в течение 6 дней или по 1 г однократно.
Мидекамицин (макроен)- по 400 мг 3 раза в сутки в течение 7-14 дней.
Эритромицин (эритромицин, эрифлюид) по 500 мг 4 раза в сутки 7-14 дней.
Рокситромицин (роксид, рокситромицин, рулид) по 150 мг 2 раза в сутки 7-14 дней.
При приеме внутрь кларитромицин, в отличие от эритромицина, устойчив в кислой среде желудка, и поэтому назначается независимо от приема пищи. Этот параметр также положительно влияет на биодоступность препарата. Период выведения основного вещества составляет около 3,5-4,5 ч, его метаболитов — 7,5-8,5 ч. Это обусловливает быстрое, мощное и пролонгированное действие кларитромицина в сравнении с эритромицином. Важнейшим аспектом механизма действия кларитромицина, особенно актуальным — когда речь идет о лечении уреаплазменной инфекции, является его высокая способность к проникновению внутрь клеток. Препарат активно накапливается в лимфоцитах, лейкоцитах и макрофагах, в результате чего создается его высокая тканевая концентрация в пораженных органах. Абсолютная биодоступность составляет более 50%. Содержание в тканях обычно в несколько раз больше, чем в сыворотке. Кларитромицин является ингибитором повторного роста бактерий, что обусловливает выраженный постантибиотический эффект. До настоящего времени нет сообщений об устойчивости уреаплазм к кларитромицину.
Вследствие высокой МПК уреаплазмы практически устойчивы к линкозаминам — линкомицину и клиндамицину, а также к «старым» макролидам — олеандомицину и спирамицину.
Во время беременности нежелательно назначать азитромицин, рокситромицин, кларитромицин и мидекамицин. Для лечения беременных женщин с уреаплазменной инфекцией рекомендовано применять эритромицин внутрь по 500 мг каждые 6 ч в течение 7-10 дней. Показано, что после такого лечения уменьшаются угроза прерывания беременности, частота самопроизвольных абортов и явления многоводия.
Для лечения беременных рекомендован также джозамицин. Он обладает высокой эффективностью, не вызывая побочных реакций со стороны печени, не влияет на метаболизм других препаратов. При этом действие джозамицина на естественную бактериальную флору невелико.
При рождении детей, внутриутробно инфицированных уреаплазмами, также проводят терапию эритромицином. Предпочтительно внутривенное, капельное назначение препарата из расчета 20-40 мг на 1 кг массы тела.
Фторхинолоны
Все виды микоплазм высоко чувствительны к новым фторхинолонам, особенно офлоксацину. Его лидирующее положение в этой группе обусловлено широким антибактериальным спектром воздействия, высокой бактерицидной активностью, хорошими фармакокинетическими характеристиками (быстротой всасывания, высокими концентрациями препарата в тканях, клетках, биологических жидкостях), низкой токсичностью.
Офлоксацин (заноцин, офло, тарицин) назначают по 200 мг 2 раза в сутки в течение 7-10 дней, пефлоксацин — по 600 мг 1 раз в сутки в течение 7-10 дней, моксифлоксацин (авелокс) по 400 мг 1 раз в сутки в течение 10 дней.
Следует отметить, что исследования антибиотикочувствительности уреаплазм показывают частую их резистентность в клинической практике к офлоксацину и другим фторхинолонам.
Как и в случае с тетрациклинами, препараты этой группы нежелательно применять у беременных, они также вызывают фотосенсибилизацию.
Уреаплазмы среднечувствительны к аминогликозидам и левомицетину. Из аминогликозидов наиболее эффективен гентамицин, который назначают парентерально по 40 мг каждые 8 ч в течение 5 дней. Стрептомицин и канамицин при уреаплазменной инфекции практически неэффективны.
В последние годы как в нашей стране, так и за рубежом участились случаи выявления микоплазм, генетически резистентных к тетрациклину (до 40%), эритромицину, спирамицину (до 30%) и ципрофлоксацину.
Для выбора схемы адекватной терапии в конкретных случаях рекомендуется лабораторное определение чувствительности выделенных культур уреаплазм к различным антибиотикам. Однако многие авторы отмечают способность уреаплазм быстро приобретать устойчивость к антибактериальным препаратам при их пассировании in vitro. Следовательно, необходимо тестирование свежевыделенных от больных штаммов. Другая сложность состоит в том, что чувствительность к антибиотикам in vitro не обязательно коррелирует с положительным эффектом in vivo. Это может быть связано с фармакокинетикой препаратов. Анализ исследований, посвященных лечению уреаплазменной инфекции, показывает чрезвычайно большой разброс показателей эффективности различных антибиотиков — от 40 до 100%. В независимых исследованиях критерий эффективности того или иного антибиотика при уреаплазменной инфекции редко превышает 80%.
В ряде случаев этиотропная терапия может являться частью комбинированной терапии, в частности иммунотропной. В работе Hadson MMT et al. (1998) сообщается о важности иммунологического статуса больного при уреаплазменной инфекции. Так как антибиотики, активные в отношении уреаплазм, обладают бактериостатическим, а не бактерицидным действием, определяющую роль играет иммунный ответ больного. Использование иммунотропной терапии может быть особенно актуальным при неэффективности хотя бы одного курса противомикробного лечения.
Наши собственные исследования показали, что при выборе иммунотропной терапии особенно высокую эффективность демонстрировал препарат иммуномакс.
Этот препарат относится к группе иммуномодуляторов и показан для коррекции ослабленного иммунитета, лечения и профилактики вирусных и бактериальных инфекций.
Когда имеются показания для комбинированной терапии уреаплазменной инфекции, больным назначают антибиотик одновременно с внутримышечными инъекциями иммуномакса. Мы применяли одновременно с 10-дневным стандартным курсом антибактериальной терапии доксициклином или кларитромицином иммуномакс по 200 ЕД на 1- 3-й, 8- 10-й дни лечения. Инъекции выполняли 1 раз в сутки, на курс из 6 инъекций. У 20 из 23 (87%) больных при диагностике, проводившейся через 2 нед по окончании лечения и через 3 мес контрольного наблюдения, уреаплазм не выявлялось.
Суммируя вышеизложенное, можно констатировать, что при лечении больных уреаплазменной инфекцией из всех антибиотиков следует отдавать предпочтение доксициклину из группы тетрациклинов, кларитромицину из группы макролидов, джозамицину — при беременности.
Наиболее удачной комбинацией при резистентных к стандартной этиотропной терапии случаях уреаплазменной инфекции, а также при рецидивирующем течении этой инфекции является применение антибиотиков в сочетании с иммунотропным лечением, что позволяет добиться элиминации возбудителя и избежать рецидивов инфекции.
М. А. Гомберг, доктор медицинских наук А. М. Соловьев, кандидат медицинских наук ЦИКВИ, МГМСУ, Москва
Чувствительность уреаплазм к различным антибактериальным агентам (МПК в мкг/мл)
| Антибиотик | МПК |
| Тетрациклины | |
| Тетрациклин | 0,05 — 0,6 |
| Окситетрациклин | 0,5 — 62 |
| Хлортетрациклин | — |
| Доксициклин | 0,01 — 1,0 |
| Миноциклин | 0,5 — 62 |
| Макролиды, линкозамины, стрептограмины | |
| Эритромицин | 0,12 — 3,0 |
| Олеандомицин | 5,9 |
| Спирамицин | 16,0 — 41,9 |
| Джозамицин | 0,02 — 0,45 |
| Мидекамицин | 0,06 — 0,6 |
| Кларитромицин | 0,015 — 1,0 |
| Рокситромицин | 0,06 — 1,0 |
| Азитромицин | 0,12 — 1,0 |
| Линкомицин | 73 |
| Пристинамицин | 0,1 — 1,0 |
| Клиндамицин | 2,62 |
| Фторхинолоны | |
| Офлоксацин | 1,0 — 4,0 |
| Ципрофлоксацин | 0,25 — 0,1 |
| Норфлоксацин | 2,0 — 4,0 |
| Ломефлоксацин | 2,0 — 8,0 |
| Пефлоксацин | 4,0 — 8,0 |
| Аминогликозиды | |
| Стрептомицин | 0,4 — 12,5 |
| Канамицин | 1,6 — 50 |
| Гентамицин | 0,4 — 6,2 |
| Другие группы | |
| Левомицетин | 0,5 — 6,2 |
Стоит ли лечить молочные зубы под наркозом (седацией)
Несмотря на то, что молочные зубы многие родители считают как бы ненастоящими (или напротив, по природе более защищенными) и недооценивают возникающие с ними проблемы, все же лечить молочные зубы больно — так же как и коренные. Поэтому важно обращаться именно в детскую стоматологию — поскольку требования к анестезирующим средствам для детей более строгие, и необходимые препараты могут отсутствовать в обычной «взрослой» клинике.
Во многих случаях лечить молочные зубы под наркозом не только можно, но и нужно. Следует различать наркоз и седацию. Седация — это успокоение маленького пациента, снятие излишней возбужденности или испуга перед стоматологическими манипуляциями. Оно достигается легкими безопасными средствами (например, закисью азота) и не сопровождается обезболиванием.
Наркоз же подразумевает засыпание пациента и лечение зубов во сне. Для детей допускается применение двух препаратов: севорана, подающегося через специальную маску, и пропофола, вводящегося внутривенно. Это безопасные, хорошо проверенные средства, имеющие высокую эффективность и не оказывающие влияния на нервную систему ребенка.
Наркоз применяется в случаях, когда с ребенком врачу трудно установить контакт, или присутствует патологическая боязнь стоматологических процедур. А также когда предполагается объемное или сложное вмешательство: удаление нескольких зубов, лечение глубокого кариеса или пульпита и т.д. Ребенку-дошкольнику (или младшему школьнику) очень трудно неподвижно сидеть в кресле дольше 20-30 минут, а наркоз позволит ему получить необходимо лечение в полном объеме, совершенно незаметно и безболезненно.
Способы лечения кариеса у детей – без боли и страха
Для лечения кариеса молочных зубов предусмотрено немало методик. Все они адаптированы для детского возраста – не причиняют боли, дискомфорта или беспокойства ребенку. В зависимости от сложности ситуации стоматологи предлагают следующие решения:
- Реминерализация зубной эмали – восстановление сбалансированной структуры поверхности зуба с помощью специальных паст. На молочные зубки в течение некоторого времени нужно наносить составы с высоким содержанием кальция и натрия, что позволит остановить распространение бактерий и углубление кариозных полостей.
- Метод ICON (Айкон) – идеальный вариант лечения поверхностного кариеса. Врач наносит на кариозное пятно состав для удаления пораженного участка эмали, а затем закрывает полость безопасным быстроотвердевающим полимером. Лечение проходит без бормашины – быстро и безболезненно.
- Озонотерапия – действенная методика борьбы с кариесом. Поврежденный участок подвергают целенаправленному воздействию озона – для дезинфекции эмали и устранению кариозных бактерий. Дети переносят процедуру очень хорошо, так как она не причиняет никакого дискомфорта.
- Пломбирование. Очистка кариозных полостей производится с помощью бормашины или вручную без сверления. Далее врач обрабатывает зубик антисептиками и ставит пломбу – белую или цветную. Лечение кариеса молочного зуба проводят с обезболиванием местными анестетиками или же под седацией.
- Лечение зубов лазером. Передовая технология, в которой лазерные лучи удаляют кариозные очаги быстро и аккуратно. На очищенную и обеззараженную полость ставится пломба.
Способ лечения кариеса предлагается врачом после оценки степени поражения молочного зуба.
В каком возрасте стоит лечить детям молочные зубы?
Лечить молочные зубы необходимо в любом возрасте. В первые годы, когда прорезываются молочные зубы, дети часто ограничены в сладком и кариес у них развивается нечасто. В возрасте 3-5 лет ситуация усложняется в силу того, что сладости становятся более доступны, а чистка зубов часто проводится нерегулярно и без должного старания.
Примерно в 5-6 лет молочные зубы начинают сменяться постоянными. Обычно этот процесс завершается к 14 годам, хотя нередко встречаются отклонения в ту или иную сторону. Родителям нет смысла ждать какого-то определенного времени, чтобы начать серьезно заниматься зубами ребенка и водить его к стоматологу. Как мы уже говорили, заболевания молочных зубов могут привести к их несвоевременной потере и даже нанести ущерб будущим постоянным зубам. Разрушенные и преждевременно потерянные молочные зубы могут спровоцировать проблемы с дикцией, помешать ребенку нормально пережевывать пищу и вызвать проблемы с пищеварением.
Поэтому с самого начала важно приучать детей к регулярной гигиене ротовой полости, ограничивать их неуемную любовь к сладостям и периодически водить на профилактический прием к стоматологу. Для того, чтобы дети не боялись зубного врача, важно выбрать хорошую клинику, в которой принимают именно детские стоматологи, с опытом лечения молочных зубов и внимательным отношением к маленьким пациентам. Если ребенок будет знать, что посещение стоматолога совсем не обязательно означает что будут сверлить зубы, то будет с большим спокойствием принимать эти регулярные визиты, а его улыбка всегда будет безупречной.
Профилактика – лучшее решение вопроса
Для того чтобы вам не пришлось мучиться сомнениями лечить или удалять молочные зубы, организуйте правильно питание ребенка и уход за полостью рта.
Старайтесь, чтобы малыш не потреблял в пищу много сладостей, по возможности сократите количество сладких соков и газированных напитков в рационе. И, конечно, позаботьтесь о регулярной и правильной чистке зубов.
Ребенок должен чистить зубы 2 раза в день: утром и вечером. При этом после вечерней чистки зубов не допускайте никаких перекусов. Если малышу еще нет двух лет – чистите ему зубки сами. В этом возрасте, кстати, обязательно используйте специальные зубные пасты, рекомендованные для детей от 0 лет, например, «АСЕПТА baby».
Более взрослые дети уже должны чистить зубы сами, но обязательно под присмотром взрослых. С двух лет также посещайте стоматолога не менее 2 раз в год. Только так вы сможете предотвратить развитие серьезных заболеваний зубов и обеспечить своевременное решение всех возникающих проблем.
Самые распространенные стоматологические заболевания в детском возрасте
Среди основных проблем, заставляющих детей проходить стоматологическое лечение:
- Кариес. С ним малыши сталкиваются чаще всего. Заболевание обнаруживается более чем у 60% детей в возрасте до шести лет. Особенно часто оно поражает моляры. Это обусловлено их рельефной объемной поверхностью и условиями питания малыша. На коронке моляров зубной налет откладывается более активно. В нем размножаются болезнетворные микроорганизмы. Результат их жизнедеятельности — прогрессирующий кариес. Сложность в том, что на первых этапах обнаружить кариозную полость самостоятельно родителям удается не всегда. Она выглядит, как светлое пятнышко, и практически сливается со здоровой окружающей эмалью. Не зная о наличии заболевания, мамы и папы откладывают визит к детскому стоматологу. Когда же ребенок попадает на прием, кариозное «дупло» уже оказывается очень большим.
- Периостит (флюс). Осложнение запущенного кариеса, обусловленное распространением бактерий, поражением зубных корней и тканей, прилегающих к ним. Щека опухает. На поверхности десны формируется объемный гнойник. При его пальпации возникает острая боль. При флюсе может ухудшаться общее состояние малыша.
- Периодонтит. Воспалительное поражение периодонта. Последний образуют: периодонтальная связка, десна, цемент корня и альвеолярная кость. Малышу больно кусать твердую пищу. У него повышается температура, появляются головные боли.
Все эти стоматологические болезни хорошо поддаются лечению. Самое главное — не откладывать обращение в клинику стоматологии на потом.
Правда ли, что у молочных зубов нет нервов, и они не болят?
Молочные зубы ничем не отличаются от постоянных. Они имеют и нервы, и корни (к моменту смены на постоянные зубы они рассасываются самостоятельно). Конечно же, именно поэтому очень важно проводить лечение их и анестезией. Правда, молочные зубы даже при значительном их разрушении могут действительно не болеть долгое время, это связано с особенностями их строения. Но со временем и они могут заболеть. Поэтому ни в коем случае не нужно ждать этого, так как всегда сложнее проводить лечение ребенку с острой болью – он находится в стрессе, а на адаптацию совсем нет времени. Возможно, и зуб вылечить вряд ли удастся — его придется удалять.
Может не стоит лечить зуб, а просто его удалить?
Ребенка проще будет уговорить пролечить зуб, нежели удалить его. Даже под влиянием современной анестезии пациент не теряет тактильной чувствительности (боль не возникает, но есть раскачивание, давление). Дети же такие ощущения способны воспринимать как боль. Врачебные манипуляции во время лечения зуба намного нежнее. Также при ранней потере одного зуба (и особенно нескольких) может вызвать проблемы с речью и нарушение прикуса. Не забывайте также о психологическом аспекте: очень часто детей, у которых нет передних зубов, начинают дразнить сверстники.
Особенности лечения детских зубов
Лечение зубов в детском возрасте предполагает соблюдение ряда особенностей. Методы похожи на те, что применяются для взрослых, однако есть некоторые различия. Вообще, детская стоматология — это отдельный «мир», в котором работают только опытные врачи, знающие подход к детям. Здесь требуется большой опыт и навыки общения с маленькими пациентами, так как в некоторых случаях приходится изрядно постараться, чтобы успокоить ребенка и провести лечение в благоприятной для него обстановке.
Как лечат зубы в 1 год
Первое посещение врача-стоматолога рекомендовано в возрасте одного года. Во время первичного приема специалист тщательно осматривает не только молочные зубы, но и уздечки — губ и языка. Визит к врачу в этом возрасте крайне необходим, чтобы своевременно обнаружить, а затем устранить:
- дефекты прикуса;
- аномалии уздечки;
- патологии десен и другие возможные нарушения.
Если во время осмотра обнаружены какие-либо заболевания, специалист назначает лечение. Если есть предположение, что манипуляции могут причинить ребенку боль или дискомфорт, используется анестезия.
Как лечат зубы в 2–3 года
В возрасте от двух до трех лет, в целях профилактики ребенка следует отвести на прием не только к стоматологу, но и к гигиенисту, так как в этот период у большинства детей обычно прорезываются все молочные зубы, а им требуется особый уход. На первичном приеме врач осматривает полость рта и оценивает правильность прикуса. Кроме того, все молочные зубы проверяются на наличие кариозных полостей.
Чаще всего в 2–3 года диагностируется кариес на стадии «пятна», когда еще не поражены глубокие тканевые структуры. В таком случае обычно применяются два способа лечения:
- Реминерализация.
Процедура безболезненная и проводится без анестезии. В основе метода лежит использование специальных составов на основе фтора, кальция и фосфора. Средство наносится непосредственно на пораженную область и позволяет восстановить минеральный баланс зуба.
- Серебрение.
Во время процедуры зубы покрывают специальным составом на основе серебра, что позволяет защитить эмаль на долгое время и предотвратить повторное развитие кариеса.
Чаще всего при помощи таких методов пятно устраняется без инструментального вмешательства. Если же кариес затронул более глубокие слои, без удаления пораженных тканей, очищения и пломбирования не обойтись.
Как лечат зубы в 4–5 лет
Если во время диагностики врач обнаружил кариес — наиболее распространенное заболевание в этом возрасте, назначается лечение по следующему алгоритму:
- обработка полости рта антисептическими препаратами;
- нанесение на десны «замораживающих» средств в области введения анестетика;
- инъекционное введение анестезии;
- удаление пораженных тканей при помощи специальных инструментов или бормашины;
- пломбирование.
Весь процесс занимает около 30–40 минут, иногда больше — в зависимости от размера и степени тяжести кариеса, при этом ребенок ничего не чувствует, так как процедура проводится только после того, как подействует анестезия.
Если диагностированы заболевания десен, чаще всего назначаются средства локального нанесения — мази, кремы, гели, а также полоскание полости рта аптечными растворами или настойками из лечебных трав. При тяжелых формах патологий могут назначаться медикаменты, которые устраняют воспаление и снимают болезненную симптоматику.
Как лечат зубы детям старше 5 лет
В возрасте от 5 до 7 лет начинается смена молочных зубов на постоянные. В этот период требуются особо тщательная гигиена и регулярные посещения стоматолога, так как необходимо контролировать состояние эмали, которая формируется постепенно — на протяжении 2–4 лет.
После 7 лет нередко возникают проблемы с прикусом. Обусловлено это тем, что вместо постепенного увеличения челюсти пропорционально росту постоянных зубов, происходит какой-либо сбой, вследствие чего и появляются аномалии — неполное смыкание, смещение зубного ряда, нарушения прикуса и прочее. В таких случаях терапевтический курс включает не только ношение брекет-систем и других ортопедических конструкций, но и посещение логопеда.